La configuración electrónica del átomo de un elemento corresponde a la ubicación de los electrones en los orbitales de los diferentes niveles de energía. Aunque el modelo de Scrödinger es exacto sólo para el átomo de hidrógeno, para otros átomos es aplicable el mismo modelo mediante aproximaciones muy buenas.
La manera de mostrar cómo se distribuyen los electrones en un átomo, es a través de la configuración electrónica. El orden en el que se van llenando los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. El esquema de llenado de los orbitales atómicos, lo podemos tener utilizando la regla de la diagonal, para ello debes seguir atentamente la flecha del esquema comenzando en 1s; siguiendo la flecha podrás ir completando los orbitales con los electrones en forma correcta.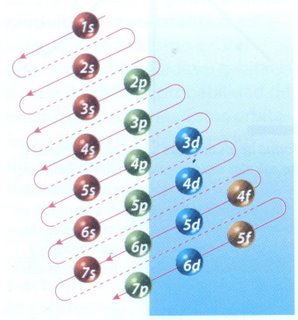

Escribiendo configuraciones electrónicas
Para escribir la configuración electrónica de un átomo es necesario:
- Saber el número de electrones que el átomo tiene; basta conocer el número atómico (Z) del átomo en la tabla periódica. Recuerda que el número de electrones en un átomo neutro es igual al número atómico (Z = p+).
- Ubicar los electrones en cada uno de los niveles de energía, comenzando desde el nivel más cercano al núcleo (n = 1).
- Respetar la capacidad máxima de cada subnivel (s = 2e-, p = 6e-, d = 10e- y f = 14e-).
Ejemplo:
Los orbitales se llenan en orden creciente de energía, con no más de dos electrones por orbital, según el principio de construcción de Aufbau.
Litio (Z = 3). Este elemento tiene 3 electrones. Empezaremos llenando el orbital de menor energía con dos electrones que tendrán distinto spin (ms). El electrón restante ocupará el orbital 2s, que es el siguiente con menor energía:

La flecha indica el valor del cuarto número cuántico, el de spin: para +1/2: y para –1/2, respectivamente.
También podemos describir la distribución de electrones en el átomo de litio como:
Los electrones que tienen números de espín opuestos cancelan los efectos magnéticos y se dice que sonelectrones apareados. Un ejemplo son los dos electrones que ocupan el orbital 1s en el átomo de Litio. De manera similar decimos que el electrón que ocupa el orbital 2s orbital está desapareado.
En la tabla a continuación vemos como se distribuyen los electrones de los átomos en orden creciente a su número atomico (Z):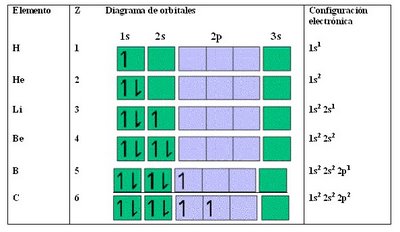

También podemos describir la distribución de electrones en el átomo de litio como:

Los electrones que tienen números de espín opuestos cancelan los efectos magnéticos y se dice que sonelectrones apareados. Un ejemplo son los dos electrones que ocupan el orbital 1s en el átomo de Litio. De manera similar decimos que el electrón que ocupa el orbital 2s orbital está desapareado.
En la tabla a continuación vemos como se distribuyen los electrones de los átomos en orden creciente a su número atomico (Z):

En el helio se completa el primer nivel (n=1), lo que hace que la configuración del He sea muy estable.
Para el Boro el quinto electrón se sitúa en un orbital 2p y al tener los tres orbitales 2p la misma energía no importa cuál de ellos ocupa.
En el carbono el sexto electrón podría ocupar el mimo orbital que el quinto u otro distinto. La respuesta nos la da:
la regla de Hund: la distribución más estable de los electrones en los subniveles es aquella que tenga el mayor número de espínes paralelos.Los electrones se repelen entre sí y al ocupar distintos orbitales pueden situarse más lejos uno del otro. Así el carbono en su estado de mínima energía tiene dos electrones desapareados, y el nitrógeno tiene 3.
Para el Boro el quinto electrón se sitúa en un orbital 2p y al tener los tres orbitales 2p la misma energía no importa cuál de ellos ocupa.
En el carbono el sexto electrón podría ocupar el mimo orbital que el quinto u otro distinto. La respuesta nos la da:
la regla de Hund: la distribución más estable de los electrones en los subniveles es aquella que tenga el mayor número de espínes paralelos.Los electrones se repelen entre sí y al ocupar distintos orbitales pueden situarse más lejos uno del otro. Así el carbono en su estado de mínima energía tiene dos electrones desapareados, y el nitrógeno tiene 3.

El neón completa el nivel dos y al igual que el helio tiene una configuración estable.
Las configuraciones electrónicas pueden también escribirse de manera abreviada haciendo referencia al último nivel completo. Para ello, debemos ocupar la configuración de los gases nobles, ya que ellos tienen todos su orbitales completos con electrones (s2p6), como por ejemplo en el caso del helio (s2) y neon (s2p6) como se muestra en la tabla anterior.
Las configuraciones electrónicas pueden también escribirse de manera abreviada haciendo referencia al último nivel completo. Para ello, debemos ocupar la configuración de los gases nobles, ya que ellos tienen todos su orbitales completos con electrones (s2p6), como por ejemplo en el caso del helio (s2) y neon (s2p6) como se muestra en la tabla anterior.
- Así la configuración del sodio Na, la podemos escribir como [Ne]3s1
- También podemos escribir la configuración del litio como [He]2s1
A los electrones que pertenecen a un nivel incompleto se les denomina electrones de valencia.
El gas noble Argón representa el final del período iniciado por el sodio para n=3
1s 2s 2p 3s 3p

Ar 18
[Ne] 3s2 3p6
En el siguiente elemento, el potasio con 19 electrones, deberíamos empezar a llenar los orbitales 3d. Sin embargo el comportamiento químico del potasio es similar al de litio y el sodio, ambos con un electrón de valencia desapareado en un orbital s, por lo que al potasio le correspondería la configuración [Ar] 4s1. Por lo tanto, el orbital 4s tendrá que tener menor energía que los orbitales 3d (el apantallamiento de los electrones en los orbitales 3d es mayor que el de los electrones en los orbitales 4s).
En el siguiente elemento, el potasio con 19 electrones, deberíamos empezar a llenar los orbitales 3d. Sin embargo el comportamiento químico del potasio es similar al de litio y el sodio, ambos con un electrón de valencia desapareado en un orbital s, por lo que al potasio le correspondería la configuración [Ar] 4s1. Por lo tanto, el orbital 4s tendrá que tener menor energía que los orbitales 3d (el apantallamiento de los electrones en los orbitales 3d es mayor que el de los electrones en los orbitales 4s).

Lo mismo ocurre a partir del elemento Sc (Z = 21) [Ar] 3d1 4s2. El último electrón no se agrega al subnivel 4p, sino al 3d, como lo indica el orden energético. Lo mismo sucede con las configuraciones de los emenetos Ti (Z = 22) y V (Z = 23). Con el cromo (Cr Z = 24) surge otra aparente anomalía porque su configuración es [Ar] 3d5 4s1. La lógica de llenado habría llevado a [Ar] 3d4 4s2, sin embargo la distribución fundamental correcta es la primera. Esto se debe a que el semillenado de orbitales d es de mayor estabilidad, puesto que su energía es más baja.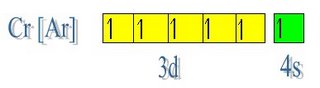

Con el cobre Cu Z = 29 sucede algo similar al cromo, pusto que su configuración fundamental es [Ar] 3d10 4s1. La configuración [Ar] 3d9 4s2 es de mayor energía. La configuración con 10 electrones en orbitales d, es decir, el llenado total de estos orbitales es más estable.







